Časté otázky, Ionizovaná voda (FAQ)
Aktívna zásaditá voda
Článok z knihy Elektroaktivovaná voda
Otázka: Zásaditá voda, aktívna zásaditá voda, ionizovaná voda, elektroaktivovaná pitná voda, kangen voda, elektrolytická voda, voda bohatá na vodík… začínam sa v tom strácať. Ktorú vodu teda odporúčate a čo je čo?
Keďže podstata elektroaktivovanej vody ešte pred niekoľkými rokmi nebola známa, od jej prvého výskytu v roku 1931 vzniklo približne 50 rôznych označení. Vynálezca Alfons → Natterer hovoril pôvodne o kyslej, zásaditej a neutrálnej elektrolytickej vode.
Rozhodujúca je jej elektrolytická výroba – na rozdiel od toho, čo nazývam → chemické ionizátory vody. Úplný prehľad jednotlivých označení a postupov nájdete na www.wasserfakten.com.
V Japonsku sa na základe inej konštrukcie článkov vyrábala najskôr iba zásaditá a kyslá voda, pre pitnú zásaditú časť vody vznikol pojem „alkalická ionizovaná voda“ (alkaline ionized water). To je nie celkom čistý pojem, pretože dva razy vyjadruje to isté.
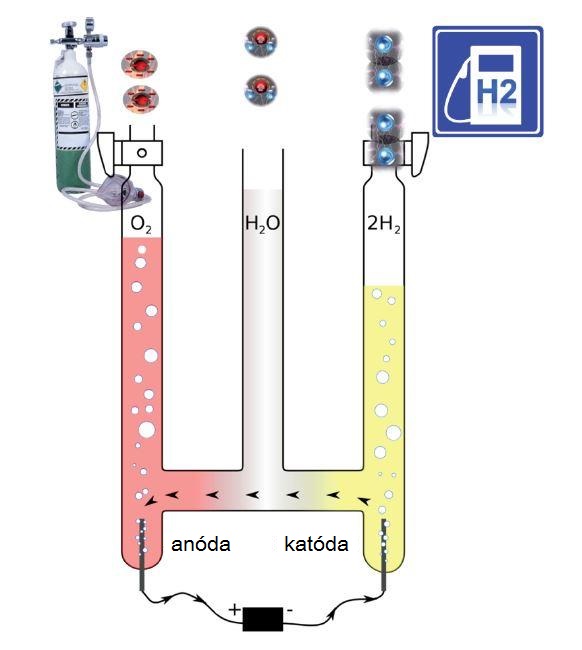
Alkalickou, teda zásaditou sa voda stane tým, že časť molekúl vody sa rozloží na kyslé a zásadité ióny (ionized) vody, ktoré sa následne oddelia, takže na jednej strane elektrolytického článku rozdeleného membránou vznikne zásaditá voda (vďaka iónom OH–) a na druhej strane kyslá voda (vďaka iónom H+). Protipólom označenia zásaditej aktívnej vody je kyslá aktívna voda (acidic ionized water). Často sa však označuje aj ako oxidačná voda.
Ale aj lekárkou Dinou Aschbachovou neskôr použitý pojem „ionizovaná voda“ je zvolený nešťastne, pretože do popredia kladie iba ióny vody. Elektrická aktivita „aktívnej vody“ sa však nezakladá priamo na zásaditom alebo kyslom charaktere, ktorý vznikne prostredníctvom iónov vody OH– a H+, ale na obohatení rozpusteným kyslíkom v kyslej vode a vodíkom v zásaditej vode.
Vďaka týmto rozpusteným plynom vzniknú nezvyčajne vysoké kladné redoxné potenciály až 1200 mV (SHE) na strane kyslíka a nezvyčajne vysoké záporné redoxné potenciály približne až -800 mV (SHE) na strane vodíka. To sú hodnoty, ktoré možno namerať elektródou SHE (vodíková elektróda).
Keďže v praxi sa však takmer vždy meria iba elektródami CSE (elektróda zo striebra/chloridu strieborného), sú to hodnoty až +993 mV (CSE) na strane kyslíka a -593 mV na strane vodíka.
To sú hodnoty pri 25 °C, kde rozdiel medzi meracou metódou SHE a CSE predstavuje +207 mV. Súvis pri iných hodnotách teploty je zrejmý z grafu vpravo.
Počas elektrolýzy vody v elektrolytickom článku s diafragmovou membránou dochádza k tvorbe oboch iónov vody H+ a OH– z molekúl vody. Zároveň sa uvoľňuje kyslík a vodík. Rozdiel na oboch stranách možno vysvetliť tým, že plynný kyslík a plynný vodík majú vo vode odlišnú rozpustnosť.
Rozpustnosť kyslíka v mg/l pri atmosférickom tlaku 1 atmosféra = 101,325 Pa
15 °C 2,756
20 °C 2,501
25 °C 2,293
30 °C 2,122
35 °C 1,982
Rozpustnosť vodíka v mg/l pri atmosférickom tlaku 1 atmosféra = 101,325 Pa
15 °C 1,510
20 °C 1,455
25 °C 1,411
30 °C 1,377
35 °C 1,350
Z dvoch molekúl vody H2O sa počas elektrolýzy uvoľnia nasledujúce množstvá plynov:
2 H2O → 2 H2 + O2
Vždy teda vznikne dvojnásobné množstvo plynného vodíka ako plynného kyslíka. Kyslík sa však napríklad pri teplote 25 °C dokáže 1,6-násobne lepšie rozpúšťať vo vode. Kam teda s výrazným prebytkom H2?
Hofmannov prístroj na rozklad vody je jedným z najobľúbenejších školských pokusov učiteľov a žiakov na hodine chémie. Vďaka šikovnej konštrukcii ním možno názorne demonštrovať rovnicu 2 H2O → 2 H2 + O2. Učiteľ chémie však musí použiť „triky“, ak chce predviesť, že oba plyny skutočne vznikajú v pomere 2 : 1. Ak voda ešte nie je nasýtená plynmi, pre odlišné hodnoty rozpustnosti a rýchlosti rozpúšťania vznikajú najskôr v pomere (kyslíka k vodíku) približne 1 : 2,5.
Na konci pokusu tak máme čistý kyslík a vodík pre obľúbený efekt výbušného plynu, ale aj kyslú vodu s nasýteným kyslíkom a zásaditú vodu s nasýteným vodíkom, v závislosti od tlaku vzduchu a teploty.
Prečo redoxný potenciál v zásaditej vode, bohatej na vodík, klesne na veľmi vysoké negatívne hodnoty?
V tejto súvislosti si treba uvedomiť, že redoxný potenciál je relatívna veličina. Redoxný potenciál je vždy hodnota elektrického napätia medzi dvoma partnermi chemickej reakcie. Za štandardný potenciál E0 bol stanovený plynný vodík (H2). V porovnaní s vodíkovou elektródou (SHE) má napríklad zlato redoxný potenciál +1680 mV, naproti tomu lítium vykazuje -3040 mV.
Na základe rozdielu napätí by tak bolo možné zhotoviť lítiovo-zlatý akumulátor s napätím 4720 mV (4,72 V). Negatívna hodnota znamená, že je tu prebytok elektrónov, pozitívna hodnota znamená tendenciu k pohlcovaniu elektrónov.
Molekula vody H2O teda pozostáva z dvoch partnerov reakcie, H2 a O. Kyslík (O) má v porovnaní s H2 pozitívny redoxný potenciál +1230 mV, je teda „lačný“ po elektrónoch. Tento rozdiel napätí 1230 mV je konštantný pri všetkých hodnotách pH a meracích metódach, aj keď sa hodnoty oboch partnerov reakcie s rastúcou hodnotou pH posúvajú smerom dole.
Aktívna zásaditá voda obsahuje viac vodíka ako kyslíka. Chýba preto (vyjadrené veľmi zjednodušene) +1230 mV: redoxný potenciál musí klesnúť.
Naviac, v pitnej oblasti aktívnej zásaditej vody pri pH 8,5 až 9,5 štandardný potenciál H2 klesol z nuly na približne -450 až -550 mV. To spôsobuje namerané nízke hodnoty redoxných potenciálov. Keďže na základe zásaditého charakteru obsahuje veľmi vysoké množstvá voľných iónov OH–, môže dôjsť napríklad k nasledujúcej reakcii uvoľňujúcej elektróny:
2 H2 + 4 OH– → 4 H2O + 4 e-
Táto reakcia vytvorí vodu plnú energie: aktívnu zásaditú vodu.
Sú to teda tri základné parametre, ktoré určujú hodnotu aktívnej zásaditej vody:
- maximálne nasýtenie rozpusteným vodíkom
- vysoký prebytok iónov OH–
- podľa možnosti úplné odstránenie plynného kyslíka.
Tieto tri parametre sa navzájom dopĺňajú. Ich súčasný výskyt možno dosiahnuť iba elektrolytickým ionizátorom vody s diafragmovou elektrolýzou. Dosiahnuť udržanie týchto troch parametrov neumožňujú tak → chemické ionizátory vody ako ani elektrolytické prístroje bez diafragmy, takzvané generátory vody bohatej na vodík.
Prvý, kto podľa môjho poznania publikoval v Nemecku pojem „aktívna zásaditá voda“, bol Dipl. Ing. Dietmar Ferger vo svojej knihe „Basisches Aktivwasser – wie es wirkt und was es kann“, ktorá vyšla v roku 2006. Túto knihu možno v súčasnosti získať v rozšírenej podobe pod názvom „Jungbrunnenwasser“. Tento pojem lepšie vyjadruje aktivitu vody, ktorá nie je iba jednoduchou „zásaditou vodou“ s vysokým pH.
Dr. med. Walter Irlacher a ja sme sa pripojili k používaniu tohto pojmu v našej knihe „Service Handbuch Mensch“, ktorá prvý raz vyšla tiež v roku 2006. V roku 2008 sme tému prehĺbili do knihy „Trink Dich basich – Das Brevier zum basischen Aktivwasser“, napísanej spolu s Fergerom.
Do roku 2008 dominoval záujem o elektrochemickú veličinu, ktorú má aktívna zásaditá voda popri svojom vyššom pH: negatívny redoxný potenciál. Ruský bádateľ Vitold Bachir si myslel že dokázal, že je abnormálne nízky a že ho nemožno opísať rovnicami klasickej redoxnej chémie. A redoxný potenciál kyslej aktívnej vody bol zasa abnormálne vysoký a tiež sa javil nevysvetliteľne.
V týchto nezvyčajných hodnotách redoxného potenciálu vedci tušili hlavnú príčinu účinkov aktívnej zásaditej (antioxidačnej) vody a aktívnej kyslej (oxidačnej) vody.
Sanetaka Shirahata predstavil v roku 1997 hypotézu, že za antioxidačným účinkom vody by mohol byť výlučne atomárny vodík. Dokázal zistiť takýto účinok aj u takých druhov vody, ktoré nemali abnormálny negatívny redoxný potenciál, no obsahovali atomárny vodík.
Výskumy Shigeoa Ohta a mnohých ďalších bádateľov na celom svete od roku 2008 ukazujú, že takýto antioxidačný účinok spôsobuje aj molekulárny, čiže plynný vodík vo vode, ktorý spôsobuje nízky redoxný potenciál. Výskum vody bohatej na vodík odvtedy patrí medzi sľubné nové oblasti medicíny.
Vďaka novým poznatkom o dôležitosti H2 (plynného vodíka) v aktívnej zásaditej vode sa aj otázka skladovania a trvanlivosti posúva do nového svetla. Kým v časoch redoxnej diskusie sa verilo, že na skladovanie sa nesmú používať kovové nádoby, aby elektróny neodtiekli, z dnešného pohľadu sú na efektívne skladovanie aktívnej zásaditej vody vhodné práve kovové nádoby, napríklad dvojstenné fľaše (termosky) z ušľachtilej ocele.
Pretože rovnako ako hrubé sklo (najmä modré) zabraňujú vyprchaniu vodíka a teda strate antioxidačného účinku. Cez v súčasnosti rozšírené plastové fľaše zasa vodík prejde veľmi rýchlo, takže voda relaxuje rýchlejšie a svoj maximálny osoh zredukuje na čisto zásaditý účinok.
Prečo je v aktívnej vode dôležitý vodík a nie kyslík v iónoch OH–, ako veril Sang Whang? Vodík je palivo, kyslík je spaľovač. Kyslík vieme priviesť do tela cez pľúca v ľubovoľno množstve. Na získanie vodíka musíme jesť.
Každý príjem potravy slúži na získanie H2, nosiča energie, ktorý je na konci všetkých metabolických procesov. Tento nosič energie môžeme prijímať jednoducho pitím aktívnej zásaditej vody.
Oxidáciou sa z vodíka po uvoľnení energie nestáva voľný radikál, ale voda. Vodík je tak nielen najmenší, ale aj nejlepší antioxidant.
Ak si chete pripraviť domácu, zásaditú vodu, neváhajte na to použiť jeden z našich profesionálnych ionizátorov vody.
© Auria, s.r.o. Všetky práva vyhradené